La protéine bêta-amyloïde humaine (1-42), également connue sous le nom d'Aβ 1-42, est un facteur clé pour percer les mystères de la maladie d'Alzheimer.Ce peptide joue un rôle central dans la formation des plaques amyloïdes, des amas énigmatiques qui endommagent le cerveau des patients atteints d'Alzheimer.Avec un effet destructeur, il perturbe la communication neuronale, déclenche une inflammation et induit une neurotoxicité, entraînant des troubles cognitifs et des lésions neuronales.L’étude de ses mécanismes d’agrégation et de toxicité n’est pas seulement vitale ;c'est un voyage passionnant vers la résolution du casse-tête de la maladie d'Alzheimer et le développement de futures thérapies.



Aβ 1-42 est un fragment peptidique de 42 acides aminés dérivé du clivage de la protéine précurseur amyloïde (APP) par les β- et γ-sécrétases.L'Aβ 1-42 est l'un des principaux composants des plaques amyloïdes qui s'accumulent dans le cerveau des patients atteints de la maladie d'Alzheimer, une maladie neurodégénérative caractérisée par des troubles cognitifs et une perte de mémoire.Il a été démontré que l'Aβ 1-42 a diverses fonctions et applications dans la recherche biologique et biomédicale, telles que :
1.Neurotoxicité : Aβ 1-42 peut former des oligomères solubles capables de se lier et de perturber le fonctionnement des membranes neuronales, des récepteurs et des synapses.Ces oligomères peuvent également induire un stress oxydatif, une inflammation et une apoptose dans les neurones, entraînant une perte synaptique et la mort neuronale.Les oligomères Aβ 1-42 sont considérés comme plus neurotoxiques que les autres formes d’Aβ, telles que l’Aβ 1-40, qui est la forme d’Aβ la plus abondante dans le cerveau.On pense également que les oligomères Aβ 1-42 sont capables de se propager de cellule en cellule, comme les prions, et de déclencher le mauvais repliement et l'agrégation d'autres protéines, comme la protéine tau, qui forme des enchevêtrements neurofibrillaires dans la maladie d'Alzheimer.
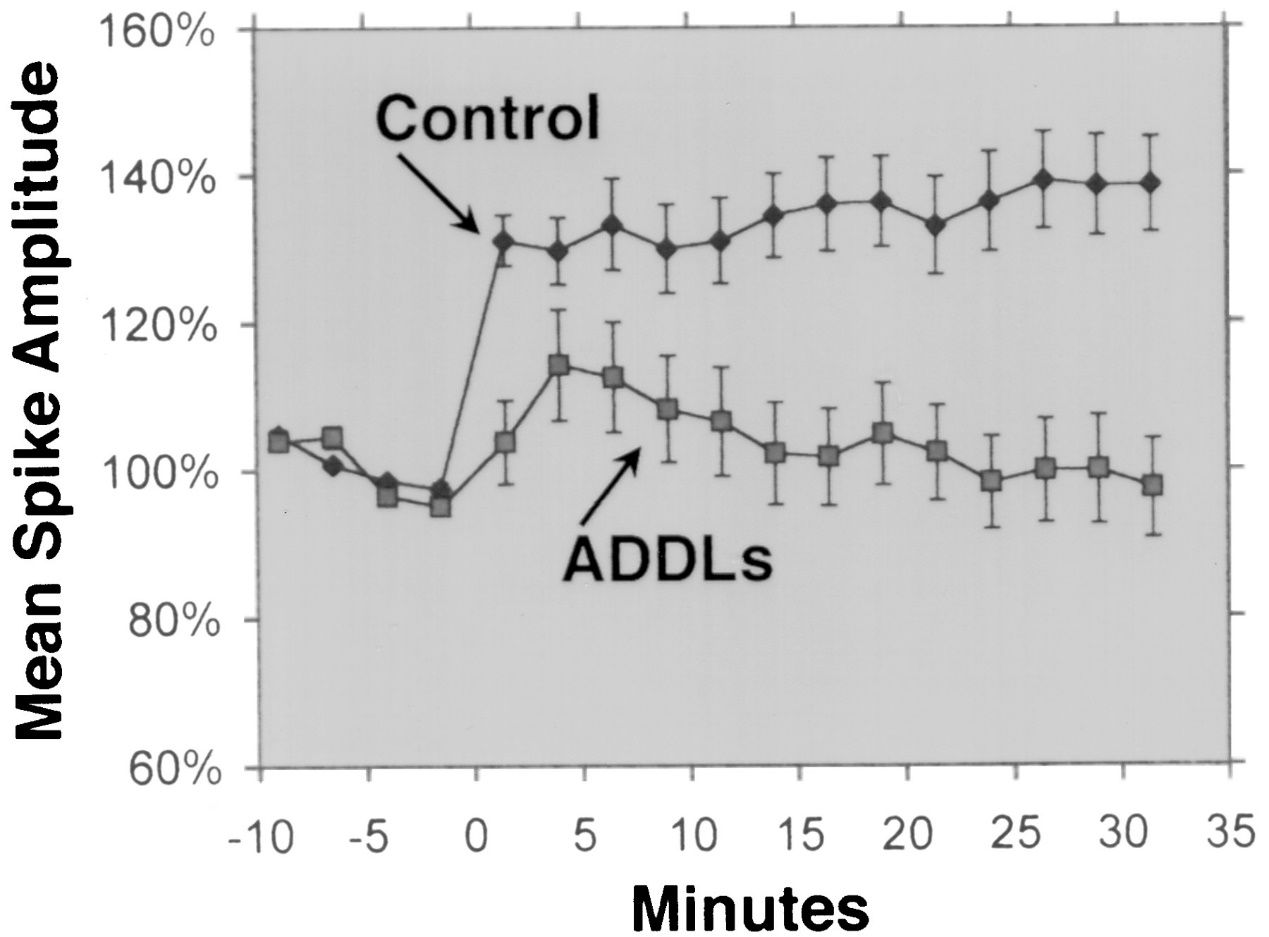
Aβ 1-42 est largement considéré comme l’isoforme Aβ présentant la neurotoxicité la plus élevée.Plusieurs études expérimentales ont démontré la neurotoxicité de l'Aβ 1-42 en utilisant différentes méthodes et modèles.Par exemple, Lesné et al.(Brain, 2013) ont étudié la formation et la toxicité des oligomères Aβ, qui sont des agrégats solubles de monomères Aβ, et ont montré que les oligomères Aβ 1-42 avaient un effet néfaste plus important sur les synapses neuronales, entraînant un déclin cognitif et une perte neuronale.Lambert et coll.(Proceedings of the National Academy of Sciences, 1998) ont mis en évidence la neurotoxicité des oligomères Aβ 1-42 et ont constaté qu'ils avaient un fort effet toxique sur le système nerveux central, éventuellement en affectant les synapses et les neurotransmetteurs.Walsh et coll.(Nature, 2002) ont montré l'effet inhibiteur des oligomères Aβ 1-42 sur la potentialisation à long terme (LTP) de l'hippocampe in vivo, qui est un mécanisme cellulaire sous-jacent à l'apprentissage et à la mémoire.Cette inhibition était associée à des troubles de la mémoire et de l'apprentissage, soulignant l'impact des oligomères Aβ 1-42 sur la plasticité synaptique.Shankar et coll.(Nature Medicine, 2008) ont isolé les dimères Aβ 1-42 directement du cerveau de la maladie d'Alzheimer et ont montré leur effet sur la plasticité synaptique et la mémoire, fournissant ainsi des preuves empiriques de la neurotoxicité des oligomères Aβ 1-42.
De plus, Su et al.(Molecular & Cellular Toxicology, 2019) ont effectué une analyse transcriptomique et protéomique de la neurotoxicité induite par Aβ 1-42 dans les cellules de neuroblastome SH-SY5Y.Ils ont identifié plusieurs gènes et protéines affectés par l'Aβ 1-42 dans les voies liées au processus apoptotique, à la traduction des protéines, au processus catabolique de l'AMPc et à la réponse au stress du réticulum endoplasmique.Takeda et coll.(Biological Trace Element Research, 2020) a étudié le rôle du Zn2+ extracellulaire dans la neurotoxicité induite par l'Aβ 1-42 dans la maladie d'Alzheimer.Ils ont montré que la toxicité du Zn2+ intracellulaire induite par l’Aβ 1-42 était accélérée avec le vieillissement en raison de l’augmentation du Zn2+ extracellulaire liée à l’âge.Ils ont suggéré que l'Aβ 1-42 sécrété en continu par les terminaisons neuronales provoque un déclin cognitif lié à l'âge et une neurodégénérescence via une dérégulation intracellulaire du Zn2+.Ces études suggèrent que l'Aβ 1-42 est un facteur clé dans la médiation de la neurotoxicité et de la progression de la maladie d'Alzheimer en affectant divers processus moléculaires et cellulaires dans le cerveau.
2. Activité antimicrobienne : Il a été rapporté que l'Aβ 1-42 possède une activité antimicrobienne contre divers agents pathogènes, tels que les bactéries, les champignons et les virus.L'Aβ 1-42 peut se lier aux membranes des cellules microbiennes et les perturber, entraînant leur lyse et leur mort.Aβ 1-42 peut également activer le système immunitaire inné et recruter des cellules inflammatoires sur le site de l'infection.Certaines études ont suggéré que l’accumulation d’Aβ dans le cerveau pourrait constituer une réponse protectrice aux infections ou blessures chroniques.Cependant, une production excessive ou dérégulée d’Aβ peut également provoquer des dommages collatéraux aux cellules et tissus hôtes.
Il a été rapporté que l'Aβ 1-42 présente une activité antimicrobienne contre une gamme d'agents pathogènes, tels que des bactéries, des champignons et des virus, tels que Staphylococcus aureus, Escherichia coli, Candida albicans et le virus de l'herpès simplex de type 1, en interagissant avec leurs membranes et provoquant leur perturbation et leur lyse.Kumar et coll.(Journal of Alzheimer's Disease, 2016) ont démontré cet effet en montrant que l'Aβ 1-42 modifiait la perméabilité membranaire et la morphologie des cellules microbiennes, conduisant à leur mort.En plus de son action antimicrobienne directe, l’Aβ 1-42 peut également moduler la réponse immunitaire innée et recruter des cellules inflammatoires sur le site de l’infection.Soscia et coll.(PLoS One, 2010) ont révélé ce rôle en rapportant que l'Aβ 1-42 stimulait la production de cytokines et de chimiokines pro-inflammatoires, telles que l'interleukine-6 (IL-6), le facteur de nécrose tumorale alpha (TNF-α), les monocytes. la protéine chimioattractante-1 (MCP-1) et la protéine inflammatoire des macrophages-1 alpha (MIP-1α), dans les microglies et les astrocytes, les principales cellules immunitaires du cerveau.
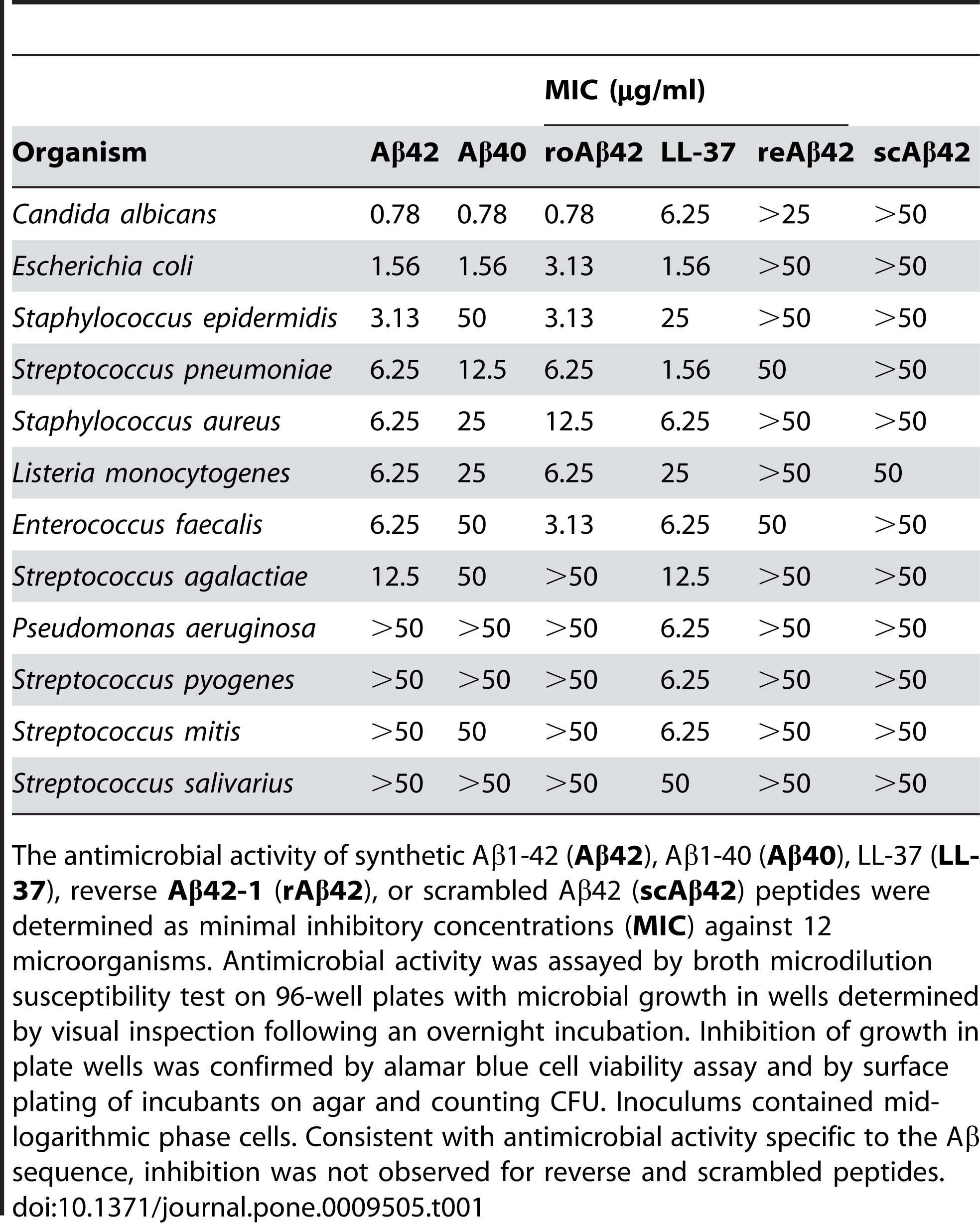
Figure 2. Les peptides Aβ possèdent une activité antimicrobienne.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. La protéine bêta-amyloïde associée à la maladie d'Alzheimer est un peptide antimicrobien. PLoS One . 3 mars 2010;5(3):e9505.)
Bien que certaines études suggèrent que l'accumulation d'Aβ dans le cerveau pourrait constituer une réponse protectrice aux infections ou blessures chroniques, l'Aβ pouvant agir comme un peptide antimicrobien (AMP) et éliminer les agents pathogènes potentiels, l'interaction complexe entre l'Aβ et les éléments microbiens reste un problème. sujet d’enquête.L'équilibre délicat est mis en évidence par les recherches de Moir et al.(Journal of Alzheimer's Disease, 2018), qui suggère qu'une production déséquilibrée ou excessive d'Aβ peut endommager par inadvertance les cellules et les tissus hôtes, reflétant la double nature complexe des rôles de l'Aβ dans l'infection et la neurodégénérescence.Une production excessive ou dérégulée d’Aβ peut conduire à son agrégation et à son dépôt dans le cerveau, formant des oligomères et des fibrilles toxiques qui altèrent la fonction neuronale et induisent une neuroinflammation.Ces processus pathologiques sont associés au déclin cognitif et à la perte de mémoire dans la maladie d'Alzheimer, une maladie neurodégénérative caractérisée par une démence progressive.Par conséquent, l’équilibre entre les effets bénéfiques et néfastes de l’Aβ est crucial pour maintenir la santé du cerveau et prévenir la neurodégénérescence.
3.Exportation de fer : Il a été démontré que l’Aβ 1-42 est impliqué dans la régulation de l’homéostasie du fer dans le cerveau.Le fer est un élément essentiel à de nombreux processus biologiques, mais un excès de fer peut également provoquer un stress oxydatif et une neurodégénérescence.Aβ 1-42 peut se lier au fer et faciliter son exportation depuis les neurones via la ferroportine, un transporteur transmembranaire du fer.Cela peut aider à prévenir l’accumulation et la toxicité du fer dans le cerveau, car un excès de fer peut provoquer un stress oxydatif et une neurodégénérescence.Duce et coll.(Cell, 2010) ont rapporté que l'Aβ 1-42 se liait à la ferroportine et augmentait son expression et son activité dans les neurones, entraînant une réduction des niveaux de fer intracellulaire.Ils ont également montré que l'Aβ 1-42 réduisait l'expression de l'hepcidine, une hormone qui inhibe la ferroportine, dans les astrocytes, améliorant ainsi l'exportation du fer par les neurones.Cependant, l’Aβ lié au fer peut également devenir plus sujet à l’agrégation et au dépôt dans l’espace extracellulaire, formant ainsi des plaques amyloïdes.Ayton et coll.(Journal of Biological Chemistry, 2015) ont rapporté que le fer favorisait la formation d'oligomères et de fibrilles Aβ in vitro et in vivo.Ils ont également montré que la chélation du fer réduisait l’agrégation et le dépôt d’Aβ chez les souris transgéniques.Par conséquent, l’équilibre entre les effets bénéfiques et néfastes de l’Aβ 1-42 sur l’homéostasie du fer est crucial pour maintenir la santé cérébrale et prévenir la neurodégénérescence.
Nous sommes un fabricant de polypeptides en Chine, avec plusieurs années d'expérience dans la production de polypeptides.Hangzhou Taijia Biotech Co., Ltd. est un fabricant professionnel de matières premières polypeptidiques, qui peut fournir des dizaines de milliers de matières premières polypeptidiques et peut également être personnalisé en fonction des besoins.La qualité des produits polypeptidiques est excellente et la pureté peut atteindre 98 %, ce qui a été reconnu par les utilisateurs du monde entier. Bienvenue pour nous consulter.






