Le 5 juillet, Novo Nordisk a lancé un essai clinique de phase III sur l'injection de CagriSema en Chine, dont le but est de comparer l'innocuité et l'efficacité de l'injection de CagriSema avec le séméglutide chez les patients obèses et en surpoids en Chine.
L'injection de CagriSema est une thérapie combinée à action prolongée en cours de développement par Novo Nordisk, dont les principaux composants sont le smeglutide, agoniste du récepteur du GLP-1 (glucagon-like peptide-1), et le cagrilintide, un analogue de l'amyline à action prolongée.L'injection de CagriSema peut être administrée par voie sous-cutanée une fois par semaine.
L'objectif principal était de comparer CagriSema (2,4 mg/2,4 mg) au séméglutide ou au placebo une fois par semaine par voie sous-cutanée.Novo Nordisk a annoncé les résultats d'un essai de CagriSema pour le traitement du diabète de stade 2, qui a prouvé que l'effet hypoglycémique de CagriSema est meilleur que celui du séméglutide, et près de 90 % des sujets ont atteint l'objectif d'HbA1c.
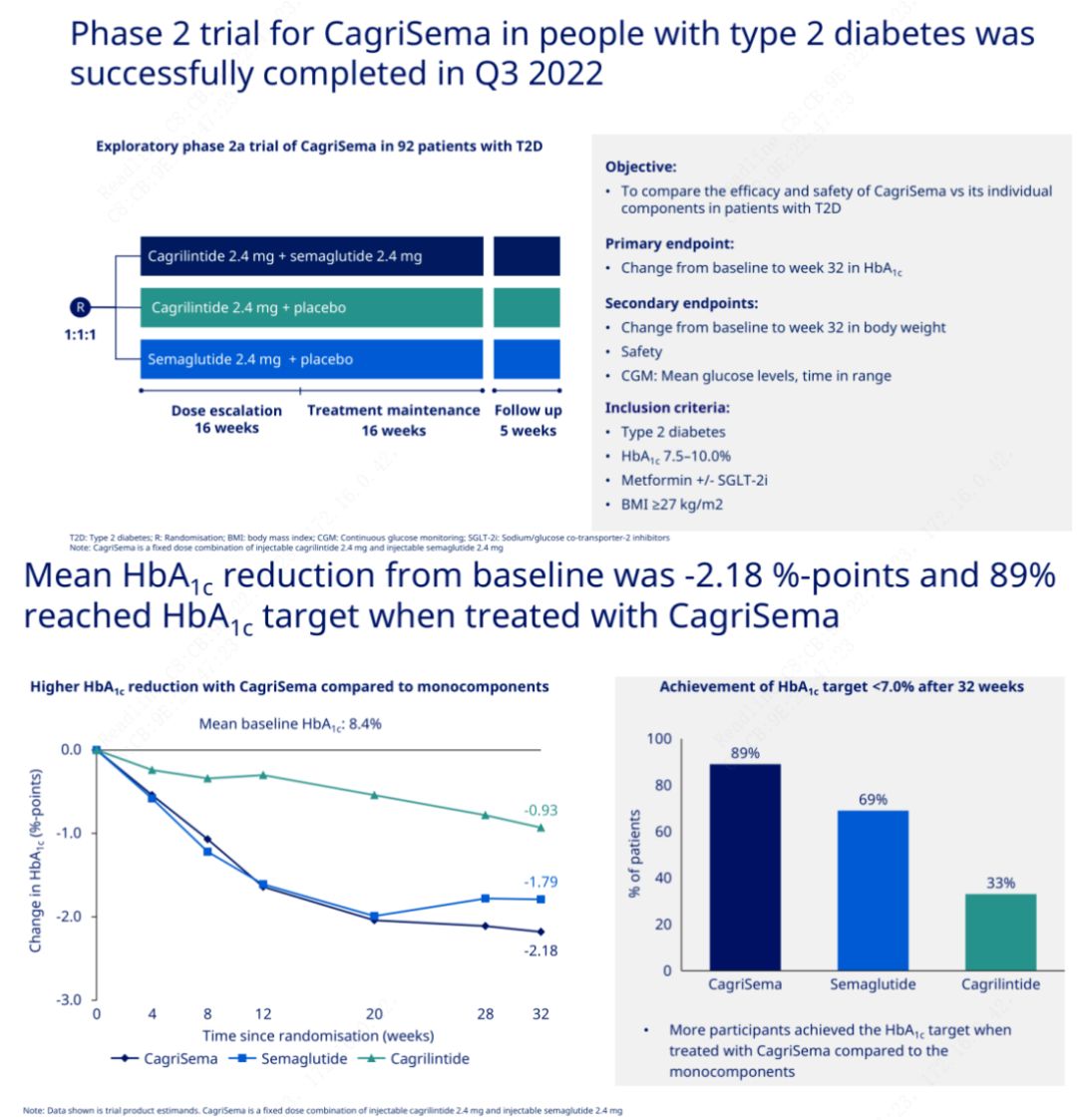
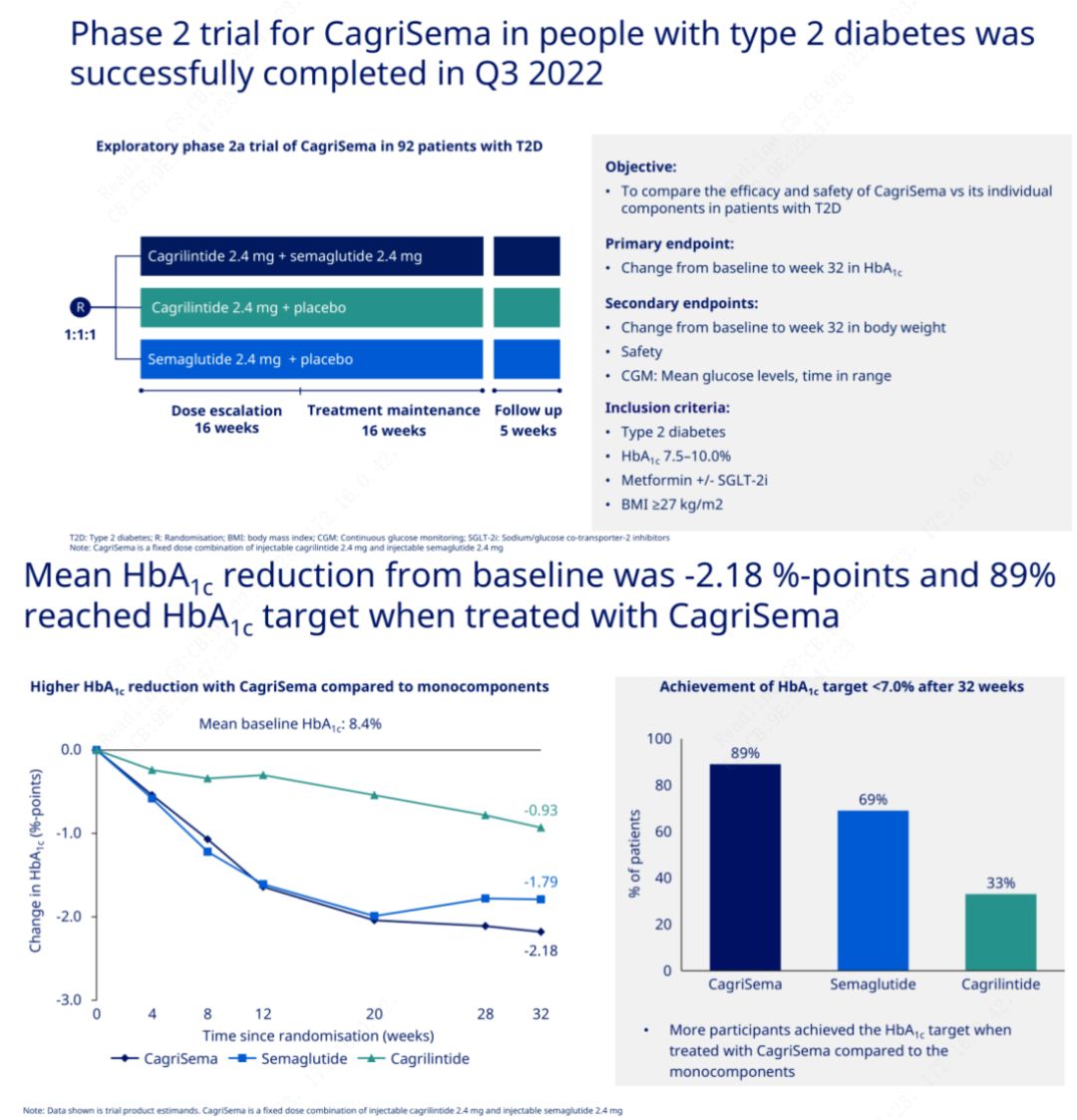
Les données ont montré qu'en plus de l'effet hypoglycémique significatif, en termes de perte de poids, l'injection de CagriSema a surpassé de manière significative le séméglutide (5,1 %) et le cagrilintide (8,1 %) avec une perte de poids de 15,6 %.
Le médicament innovant Tirzepatide est le premier agoniste hebdomadaire des récepteurs GIP/GLP-1 approuvé au monde.Il combine les effets de deux incrétines en une seule molécule injectée une fois par semaine et constitue une nouvelle classe de traitements contre le diabète de type 2.Le tirzépatide a été approuvé par la Food and Drug Administration (FDA) des États-Unis en mai 2022 pour améliorer le contrôle glycémique (sur une base alimentaire et par l'exercice) chez les adultes atteints de diabète de type 2 et est actuellement approuvé dans l'Union européenne, au Japon et dans d'autres pays.
Le 5 juillet, Eli Lilly a annoncé une étude de phase III SURPASS-CN-MONO sur la plateforme d'enregistrement des essais cliniques de médicaments et de divulgation d'informations pour le traitement des patients diabétiques de type 2.SURPASS-CN-MONO est une étude de phase III randomisée, en double aveugle et contrôlée par placebo, conçue pour évaluer l'efficacité et l'innocuité du tirzépatide en monothérapie par rapport au placebo chez les personnes atteintes de diabète de type 2.L'étude prévoyait d'inclure 200 patients atteints de diabète de type 2 qui ne prenaient aucun médicament antidiabétique au cours des 90 jours précédant la première visite (sauf dans certaines situations cliniques, telles qu'une maladie aiguë, une hospitalisation ou une intervention chirurgicale élective, à court terme (≤ 14 jours) utilisation d’insuline).
Le diabète de type 2 devrait être approuvé cette année
Le mois dernier, les résultats d'une étude SURPASS-AP-Combo ont été publiés le 25 mai dans la revue à succès Nature Medicine.Les résultats ont montré que par rapport à l'insuline glargine, le Tirzépatide a montré une meilleure réduction de l'HbA1c et du poids dans la population de patients diabétiques de type 2 dans la région Asie-Pacifique (principalement la Chine) : réduction de l'HbA1c jusqu'à 2,49 % et réduction du poids jusqu'à 7,2 kg. (9,4 %) après 40 semaines de traitement, une amélioration significative des lipides sanguins et de la tension artérielle, ainsi qu'une bonne sécurité et tolérabilité globales.
L'essai clinique de phase 3 de SURPASS-AP-Combo est la première étude de Tirzepatide menée principalement chez des patients chinois atteints de diabète de type 2, dirigée par le professeur Ji Linong de l'hôpital populaire de l'université de Pékin.SURPASS-AP-Combo est conforme aux résultats de la série mondiale de recherches SURPASS, qui prouve en outre que la physiopathologie du diabète chez les patients chinois est cohérente avec celle des patients du monde entier, ce qui constitue la base de la recherche et du développement simultanés de nouveaux médicaments. en Chine et dans le monde, et fournit également des preuves solides pour donner aux patients chinois la possibilité d'utiliser les derniers médicaments de traitement du diabète et leur application clinique en Chine dès que possible.
Heure de publication : 18 septembre 2023

